泌尿器悪性腫瘍
腎癌
更新日:2024/4/22
概説
がんとは?
がんは、異常な細胞がコントロールを受けずに増殖し広がる病気です。人間の体は無数の細胞からできています。細胞は分裂して自分と同じ細胞の複製を作ることにより増殖します。このようにして組織の新陳代謝(古いものから新しいものに変わるということ)が行われ、傷が治り、髪の毛が生えてくるのです。
異常に増殖した細胞の集団を腫瘍と呼びます。これには良性腫瘍と、悪性腫瘍すなわちがんがあります。良性腫瘍は大きくなって体の機能を妨げることはありますが、命を脅かすことは滅多にありません。一方、悪性腫瘍は大きくなるだけなく、浸潤して正常組織を破壊し、時に転移をおこします。転移とは、細胞が腫瘍から離れて血管やリンパ管を通って体の他の部位に移動して別の腫瘍を形成することです。がんの増殖スピードには早いものもあれば遅いものもあります。
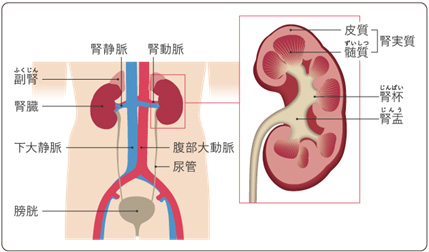
腎臓とは?
腎臓は、左右1個ずつある臓器で、背骨の両側で腰の高さに位置しています。腎臓では、血液によって運ばれてきた体内の老廃物が濾過され、不必要なものが尿として排泄されます。そのために腎臓には大量の血液が運ばれてきます。
それ以外にも腎臓では血圧を調節する物質を作ったり、ビタミンを活性化したり、血液を増やす物質を作る機能があることが知られています。
腎臓がんの原因は?
喫煙、肥満、高血圧、維持透析などが腎癌のリスク因子と言われています。
またいくつかの遺伝子変異が腎癌の発生に関わることが知られています。
診断
検査
診断は、主にMRI、CT、超音波診断、血管造影などの画像診断機器を組み合わせて行われます。これらによってあなたのからだの中の血管や組織の情報を得ます。より鮮明な血管像、組織像を得るために、造影剤の注射を同時に行うこともあります。これらの検査により、組織の写り具合、腫瘍の発生部位、大きさをみます。MRI、CT、超音波診断における得られた画像の濃度をみる事で、腫瘍が腎臓がんなのか、良性の腫瘤なのかを区別します。より侵襲性が少なく、より多くの情報が得られる方法が選ばれます。また特殊な検査として、骨に転移があるかどうかみるために、骨シンチという検査が行われます。
■CT検査
X線とコンピューターを組み合わせた診断装置。造影剤を用いない単純撮影法もありますが、一般的には造影剤を腕や足の静脈から点滴注射し、臓器、血管の染まり具合と尿中に排泄される造影剤により腎像、尿管、膀胱などの形を指標とし診断します。目的とした臓器にあわせ、連続的にX線写真を撮影し、コンピューターにより画像が作られます。比較的容易に検査でき、診断精度の高い検査ですが、造影剤にアレルギーがある人もいますし、またX線の被爆が多少あります。
■MRI検査
磁力を用いて身体の成分の反応をコンピューターで解析してフィルム上にあらわす画像検査の一種です。X線を用いたCTとよく似ていますが、血管などの軟らかい組織が骨などの硬い組織と同じくらいよく観察できます。診断精度の高い検査で、X線の被爆がなく、多少腎機能が悪くても造影検査できる利点がありますが、身体のなかに金属が入っている人は行えません。過去に心臓のペースメーカー手術、手足の金属埋込み手術などの体内に金属を埋め込むような手術を受けた方は、必ず放射線科医、泌尿器科医に伝えてください。
■骨シンチ検査
骨に転移があるかどうかみるために、弱い放射性物質を静脈注射し、その3-4時間後に写真をとる検査です。危険性や身体への負担はほとんどありません。この検査は頻繁には行いません。北大では、最初の診断時と痛みがでた時に行っています。
■組織の生検検査
これまで述べたような各種の画像診断によっても、がんか否かを診断しきれない場合があります。また転移のある腎がんで薬物治療を先行する場合も、がんの組織型を確認する必要があります。
そのような場合、針を刺して腎腫瘍の組織を採取する「腎腫瘍生検」という手技を行うことを検討します。うつ伏せの姿勢で、局所麻酔を用いて皮膚から腎臓の表面を麻酔し、超音波で腫瘍を位置を確認しながら、息を数秒止めている間に採取し、針を抜きます。組織を顕微鏡などを用いて病理学的に診ることで、「良性」か「悪性」か、より正確な診断をつけることが可能になります。
合併症としては、出血があります。
軽度の血腫であれば自然に吸収されますが、稀に輸血やカテーテルを用いて腎動脈から塞栓術を必要とする場合があります。
その他には、疼痛、感染症、腎動静脈瘻(動脈と静脈がつながってしまうこと)、麻酔薬による副反応が起こる可能性があります。
ほとんどのひとは合併症なく、2泊3日で退院できる検査になります。
※写真はイメージになります。実際にはガウンなど、清潔操作で施行します
病期(Stage)
■T分類(がんの広がり)
T0:原発腫瘍を認めない
T1:最大径が7cm以下で、腎に限局する腫瘍
T1a 最大径が4cm以下
T1b 最大径が4cmを超えるが7cm以下
T2:最大径が7cmを超え、腎に限局する腫瘍
T2a 最大径が7cmを超えるが10cm以下
T2b 最大径が10cmを超え、腎に限局する
T3:主静脈または腎周囲組織に進展するが、同側の副腎への進展がなくGerota筋膜を越えない腫瘍
T3a 腎静脈やその区域静脈に進展する腫瘍、または腎盂腎杯システムに浸潤する腫瘍、または腎周囲または腎盂周囲脂肪組織に浸潤するが、Gerota筋膜を越えない腫瘍
T3b 横隔膜下の下大静脈内に進展する腫瘍
T3c 横隔膜上の下大静脈内に進展、または下大静脈に浸潤する腫瘍
T4:Gerota筋膜を越えて浸潤する腫瘍
■N分類(リンパ節転移)
N0:領域リンパ節転移なし
N1:領域リンパ節転移あり
■M分類(別の臓器への転移)
M0:転移なし
M1:転移あり
■病期(Stage分類)
|
病期 (Stage) |
原発腫瘍 |
所属リンパ節 転移 |
遠隔転移 |
|---|---|---|---|
| Ⅰ期 | T1 | N0 | M0 |
| Ⅱ期 | T2 | N0 | M0 |
| Ⅲ期 | T3 | N0 | M0 |
| Ⅳ期 | T1, T2, T3 | N1 | M0 |
| T4 | いずれのN | M0 | |
| いずれのT | いずれのN | M1 |
腎臓がんと似ている病気は?
腎にできる病変のうち、腎臓がんと区別しなければならないものとして、腎嚢胞と腎血管筋脂肪腫があります。もちろんまれなものは他にもいくつかありますが、この2つが代表的です。どちらも良性で、ほとんどは経過観察ですみます。
■腎嚢胞(じん・のうほう)
腎臓内の水のつまった袋状構造。一種の老化現象と考えられます。完全に良性の病変ですが、まれに大きくなって周囲の組織を圧迫し腰痛を起こす事もあります。それゆえ、医師による定期的な検査が必要です。超音波検査やCT検査で診断可能です。腎臓がんでありながら嚢胞の形をとるものがあり、画像での判別が困難なこともあります。
■腎血管筋脂肪腫(じん・けっかん・きん・しぼうしゅ)
血管と筋肉と脂肪からできた腫瘍。良性ですが、すこしずつ大きくなるため定期的な検査が必要です。時に出血や疼痛をおこすことがあり、腎部分切除術や血管塞栓術が行われます。特徴的な脂肪成分が超音波検査やCT検査でわかれば診断可能ですが、それがないと腎臓がんとの区別が困難な事があります。
最近10年間の北大病院での手術結果をみたところ、腎臓がんの疑いで手術された腫瘍のうち、約5%の患者さんの腫瘍が良性でした。いろいろな検査にも関わらず、「癌である」という診断が正しくなかったわけです。この割合を減らすように努力をしていますが、画像検査だけでは100%のがんの診断はできません。特に3cm以下の小さい腫瘍では、慎重に診断を行っていますが、「とってみなければ癌かどうか判らないものがある」のです。
治療
腎臓がんの治療の根幹は手術療法です。他の臓器のがんでは、放射線療法や抗がん剤治療が有効な場合がありますが、腎臓がんでは特殊な場合を除いてあまり有効ではありません。
肺などに転移がみられた場合や、病変が大きく手術が選ばれない場合、分子標的薬と呼ばれる薬や、免疫療法、あるいはその複合治療を行います。
手術治療
■腎全摘除術
がんにおかされている腎臓全体をその周囲にある脂肪組織ごと完全に摘出する方法です。腎臓の血管を先にしばった上で、周囲組織ごと腎臓を摘出します。北大でも、7cmを超える腎臓がんの患者さんの多くはこの手術を受けられています。
この手術の利点は、
-
少なくとも1側腎臓全体をとるため、その腎臓からの再発の心配がない。
→ただし、遠隔転移がおこることを完全には防げません。 -
治療成績も確実であり、小さい偶然発見されたものでは、5年生存できる確率が90%以上とされている。すなわち、5年後に100人中90人以上の患者さんが生存しています。
しかし、欠点として、腎臓が1個になるため、将来、-
特に高血圧や糖尿病のある人、高齢の方では腎機能が低下する可能性がある。
→これについては、問題ないとする意見もあります。 - 残った反対側の腎臓にがんができる可能性があり(1-2%)、その手術が大変である。
- 交通事故や怪我で残った腎臓が傷つくと、腎不全となり血液透析が必要になる。
-
結果的に良性腫瘍だった場合、全部取らなくてもよい腎臓を1つまるごと失ってしまい、患者さんの不利益になる。
→もちろん、そうならないように慎重に診断しています
-
特に高血圧や糖尿病のある人、高齢の方では腎機能が低下する可能性がある。
■小径腎腫瘍に対する腎部分切除術
腫瘍が小さいうちに偶然発見される腎臓がん(小径腎がんとよばれます)が増えるにしたがい、行われるようになってきた方法で、腎臓がんの部分だけを摘出し、正常の腎臓部分を温存する手術です。当初は、腎臓が1個しかない患者さんや、腎機能が悪い患者さんにできた腎臓がんのみで行われてきましたが、①腎全摘術と治療効果に差がないこと、②腎機能の温存により、将来的に心筋梗塞などの心血管系イベントのリスクが下がる可能性が示され、腎機能に問題ない患者さんに対しても積極的に行われるようになりました。北大でも、腫瘍の大きさが4cm以下の場合には、原則、部分切除術を積極的にお勧めしております。現在はロボット支援腹腔鏡下腎部分切除術を積極的に行っております。
また、腫瘍の部位によっては4-7cmの場合にも部分切除術が施行できる場合もあります。
この手術の利点としては
- 腎臓が2個残るので、腎機能低下に対する心配が比較的少ない。
- 手術で切らなかった対側の腎臓にがんができても、手術による切除が選択可能になる。
などがあげられます。
しかし、欠点として、
- 手術された側の腎臓で腎臓癌が再発することがありうる。この点については、CT等により注意深く経過観察する必要があります。
- 手術手技は確立されていますが、腎全摘除術より難しい手術です。血管の多い腎の途中で切断するため、術後2週間は出血や尿が漏れる可能性があります。特に仮性動脈瘤とよばれる合併症では、血尿を生じ緊急の処置を要する可能性があります。
- 大きさが4cm以下であっても、発生部位によっては部分切除が不可能なことがありますし、術中の出血や腫瘍の状態によっては腎全摘術に変更せざるをえない場合があります。
小径腎腫瘍に対する手術術式の決定(例:ロボット支援腹腔鏡下腎部分切除術か、あるいは開腹手術での腎部分切除術が安全か?など)においては、患者さんと医師で十分な相談ののち、決定される必要があります。
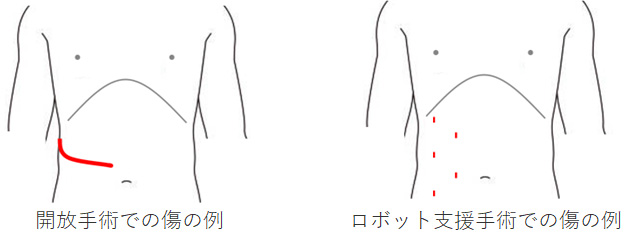
■開放手術と腹腔鏡下手術、そしてロボット支援腹腔鏡下手術へ
20-30cmの長い創が必要な開放手術と異なり、腹腔鏡下手術やロボット支援手術では3-5本の径5-12mmの筒を通してカメラ、ハサミ等を体内に入れて、腎臓を周りから剥離し、太い血管を縛り切断して、がん細胞がこぼれないように袋の中に腎臓を入れた上で体外へと取り出します。腎臓自体が握り拳の約1.5倍と大きく肋骨の裏に位置するため、従来の開放手術では大きな傷が必要でしたが、腹腔鏡手術では傷が小さく手術後の回復が非常に早く、傷の問題が少ないために、不快な症状も少な目です(下図)。腎部分切除術については、腹腔鏡手術が2002年に、ロボット支援手術が2016年に保険収載されています。
北海道大学では2003年より腹腔鏡下腎部分切除術、 2016年よりロボット支援腹腔鏡下腎部分切除術を開始しました。現在は、腎部分切除術ではロボット支援手術が主流となりつつあり2022年5月までに142例と症例を蓄積しております。Trifecta達成(温阻血時間25分以内かつ断端陰性かつ術後Grade2以上の合併症なし)の割合は80%と諸家の報告と比べても良好な手術成績を残すことができています。腹腔鏡下腎部分切除術に比較し、縫合操作や止血操作等が行いやすくなり手術時間も短縮されてきました。今後も症例を蓄積し、よりよい手術の提供を行っていきます。
■小径腎腫瘍の治療に関するその他の話題
これまで、主に腎部分切除術を中心とする手術療法について記述してきましたが、その他の話題として、1 アブレーション(凍結治療もしくはラジオ波焼灼術)と、2 積極的経過観察におけるQOL研究について述べてみたいと思います。
-
アブレーション(凍結治療もしくはラジオ波焼灼術)
腎腫瘍に針を刺し、凍結させる、あるいは焼く治療です。腫瘍側の要因として、腫瘍が外方に突出している場合には、本治療が可能である場合があります。また、患者さん側の要因として、合併症が多く全身麻酔での手術が困難な症例で選択されることがあります。2011年より凍結治療が保険収載され、治療装置を有する病院ではこの治療を受けることが出来ます(2023年2月現在、北海道大学病院では行っておりません)。標準治療である腎部分切除術に比較し、同等の治療成績が報告されています。 -
積極的経過観察
低リスクがんとよばれる悪性度が低く、生命を脅かさない可能性が高いがんにおいて、積極的経過観察という治療選択肢があるのですが、小径腎腫瘍について、その生物学的特徴が蓄積されてきており、高齢者、合併症を有する患者で積極的経過観察が選択される機会があります。海外の研究では、約300例の腎腫瘍の解析の結果、増殖速度は0.28cm/年(1年で約3mmの増大速度)で、観察期間中に転移を生じたケースは1%(3/286)であったと報告されています。高齢者の小径腎腫瘍において、積極的経過観察が選択される機会も増えていくものと思われます。また、これまでは余り行われなかった“生検”が行われる機会が増えてきました。これは腎腫瘍に針を刺し、組織を採取することで、がんか否か、がんであれば悪性度が高いか否か、を決定するプロセスです。すぐに治療を受けるべきか、経過観察が可能かどうか、治療方針の決定に利用することができます。
薬物治療
転移や局所浸潤などがあり、手術による治療が困難な腎がんには、薬物治療を行います。
腎がんには一般的な抗がん剤は効きにくいとされており、分子標的薬、免疫チェックポイント阻害薬、あるいはそれらを組み合わせた治療を主に行います。
- ■ 分子標的薬:がん細胞がもつタンパク質や遺伝子などの特定の分子をターゲットとしたお薬です。がんが増殖したり、転移したり、がんに必要な血管をつくったりする分子をターゲットとすることで、がんの活動を抑制する効果があります。一般的な抗がん剤と比べて正常細胞への影響は少ないと考えられますが、一方で高血圧、蛋白尿、手足症候群、間質性肺炎などの特有の副作用を呈することがあります。
- ■ 免疫チェックポイント阻害薬:私たちの体には細菌やウィルスなどから身を守る免疫細胞を備えています。免疫細胞の一つであるリンパ球には本来がん細胞を排除する能力がありますが、がん細胞は免疫細胞にブレーキをかける分子を用いて免疫細胞からの攻撃を免れています。免疫チェックポイント阻害薬はこのブレーキとなる分子(CTLA-4, PD-1, PD-L1)を阻害し、リンパ球ががん細胞を攻撃できるようにする効果があります。一方で、ブレーキが解除されることで正常な細胞にも免疫細胞の攻撃が向かってしまうことがあり、自己免疫による肺炎などの重篤な副作用(免疫関連有害事象)を時に引き起こすことがあります。
転移のある腎癌の初回治療では以下のような治療薬の組み合わせが考えられます。
-
1)
分子標的薬+免疫チェックポイント阻害薬の組み合わせ
多くの患者さんにおいて有効性が高い治療で、最近では初回治療として最も良く選択されています。免疫関連有害事象は一定の頻度で見られますが、免疫チェックポイント阻害薬同士の組み合わせほど高頻度ではありません。 -
2)
免疫チェックポイント阻害薬同士の組み合わせ
分子標的薬と免疫チェックポイント阻害薬の組み合わせと比べて有効の割合はや や下がりますが、極めて高い効果を発揮する患者さんがみられ、長期間にわたり 病期の進行がみられなくなる方(長期奏功)も一定数いるのが特徴です。その分免疫関連有害事象のリスクは高くなります。 -
3)
分子標的薬のみ
免疫関連有害事象の可能性がなく、副作用のコントロールが比較的しやすいため、 遠方に住んでいる患者さんなどでも選択しやすい治療法です。
治療後
腎摘除術、部分切除術
通常6-12カ月ごとを目安にCTを撮像し、再発の有無を確認します。
転移が出現した場合は薬物療法や外科的治療を行います。
治療後の通院間隔については病状や状態によって異なります。
転移のある腎癌に対する薬物療法中
通常2-3か月ごとにCTを撮像し、治療薬の有効性を確認しながら治療を行います。病気の進行がみられた場合は薬剤の変更を考慮します。
生存率
国内で2013年-2014年に診断された腎癌の5年生存率は、Ⅰ期96.7%, Ⅱ期87.6%、Ⅲ期77.0%, Ⅳ期18.3%であったと報告されています(出典:国立がん研究センターがん対策情報センターがん情報サービス)。
近年になって新しく承認された治療薬も多数あり、治療成績の向上が期待されます。
腎動脈瘤/腎動脈狭窄
骨盤臓器脱